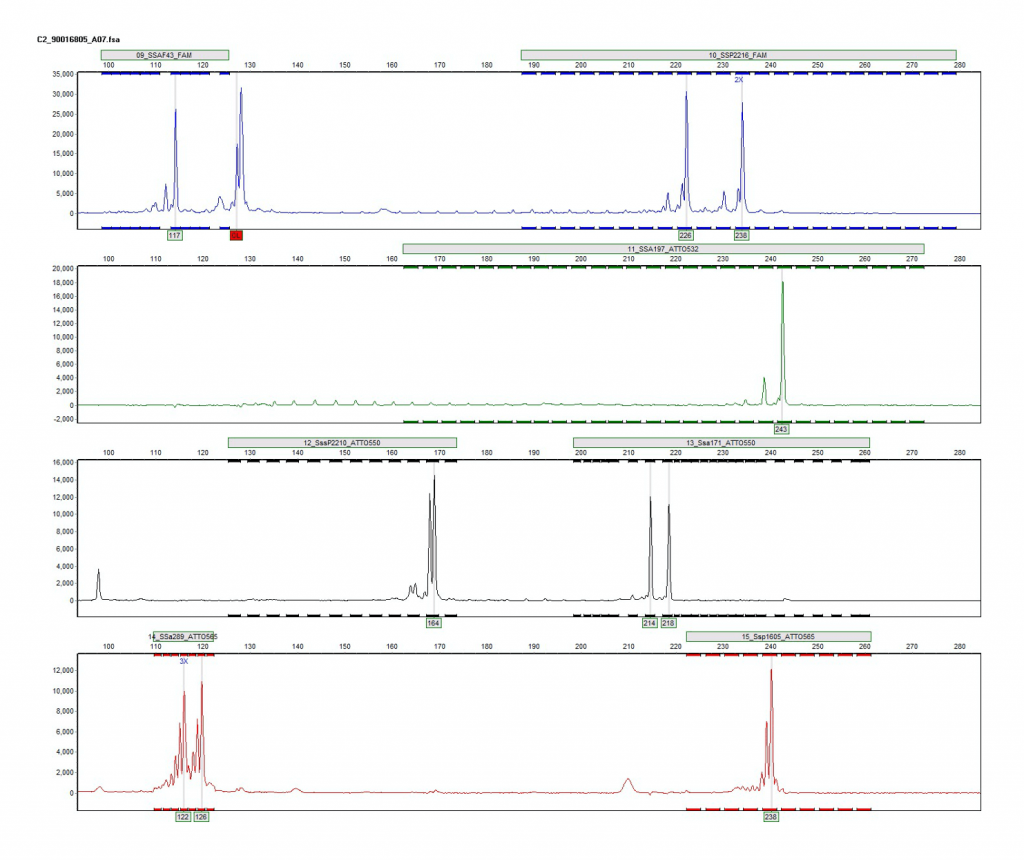
// Lachsstreuner
Lachse kehren nicht immer in die Gewässer zurück, aus denen sie als Jungfisch abgewandert sind. Die Gründe dafür sind bezogen auf das Individuum weitgehend unbekannt doch erfüllen diese Streuner als Neu- oder Wiederbesiedler und zum Erhalt eines gewissen Genflusses zwischen verschieden Populationen einer Art eine wichtige biologische Funktion. Steigen sie in einem anderen Gewässer auf, nennt man sie „Streuner“. Mittels der genetischen Analyse haben wir mehrere Streuner im deutschen Rheineinzugsgebiet identifiziert, die als Rückkehrer in einem weit entfernten Gewässer aufgestiegen sind. Auf vier Lachsrückkehrer wollen wir in diesem Bericht genauer eingehen.
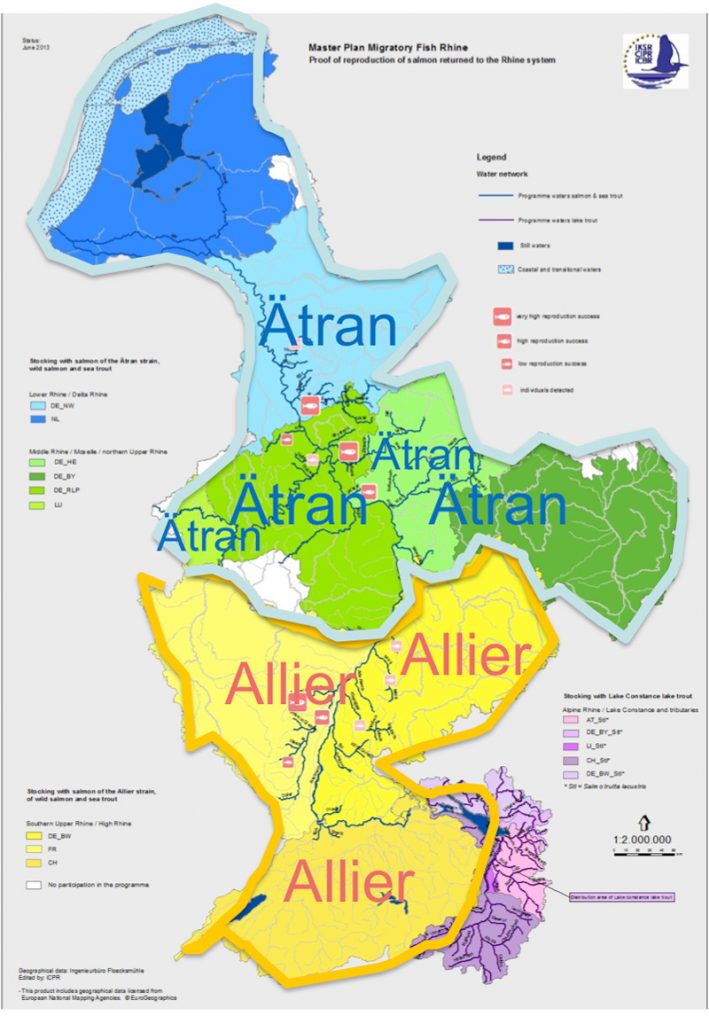
Zunächst aber zum genetischen Hintergrund der besetzten Lachse im Rheineinzugsgebiet: Im Nieder- und Mittelrhein werden Lachse mit der ursprünglichen südschwedischen Herkunft Ätran gezüchtet und besetzt (Abbildung 1). Die Lachse stammen jedoch nicht aus dem Gewässer Ätran direkt, sondern aus einem Ranchingprogramm in Dänemark, genauer aus der Lachszucht Danmarks Center for Vildlaks (DCV), Von dort aus wurden sie als Jungfische oder Augenpunkteier entweder direkt in die die Gewässer besetzt oder in Zuchten in Nordrhein-Westphalen überführt. Lachse mit dieser Herkunft werden seit 2002 im größeren Umfang seit 2004 im Nieder- und Mittelrhein besetzt. Im Oberrhein werden Lachse mit der Herkunft Allier/Loire gezüchtet und besetzt. In Baden-Württemberg und Frankreich arbeiten drei Zuchten mit Lachsen mit dieser Herkunft.
Bei den vier Lachsen, auf die wir hier genauer eingehen, handelt es sich um Streuner der Herkunft Allier/Loire, die aber im Besatzgebiet der Herkunft Ätran/DCV beprobt wurden oder um Lachse, die in die entgegengesetzte Richtung gestreunert sind.
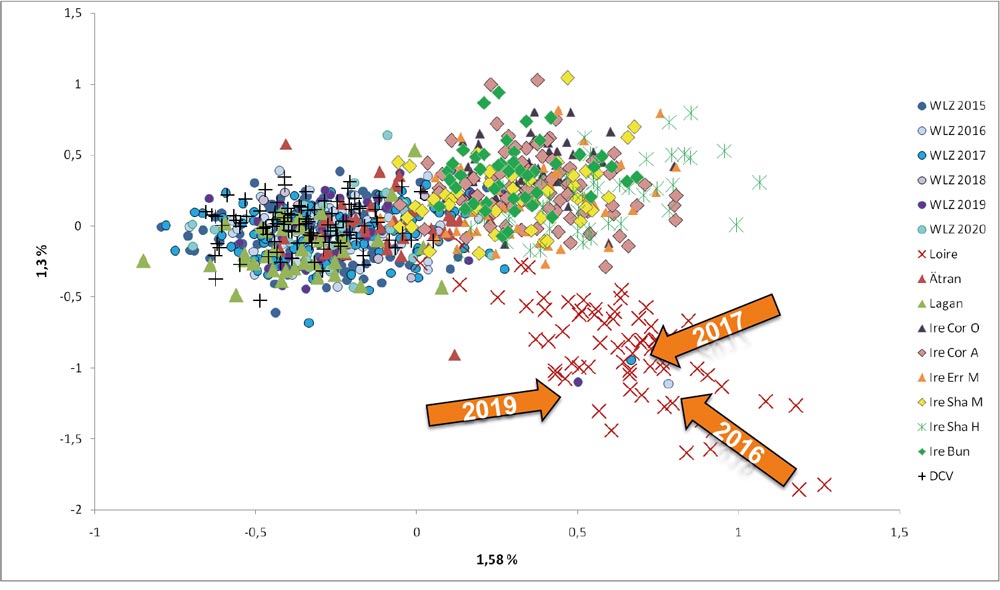
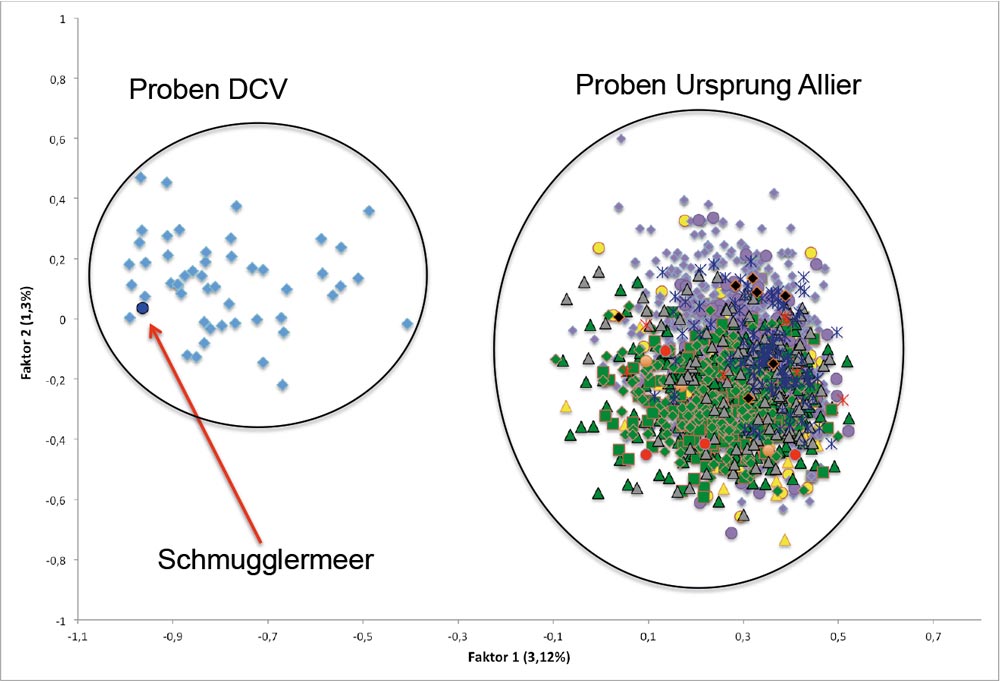
In Abbildung 2 sind die ersten beiden Faktoren einer faktoriellen Korrespondenzanalyse dargestellt. In der Graphik ist eine klare Gruppierung der Lachse mit der Herkunft DCV auf der linken Seite und den Lachsen mit der Herkunft Allier/Loire aus den Zuchten und Befischungen des Oberrheins (rechts) ersichtlich. Auffällig ist die Lachsprobe aus dem Schmugglermeer in Baden-Württemberg im Oberrheingebiet. Dieser Rückkehrer hat die Herkunft vom DCV, ist jedoch nachdem Meeresaufenthalt in das Besatzgebiet der Herkunft Allier/Loire geschwommen. Bei diesem Lachs handelt es sich daher um einen Streuner.
In entgegengesetzte Richtung sind auch in der Sieg (NRW) Lachse mit der Herkunft Allier/Loire aufgestiegen (Abbildung 3). Ein Lachsrückkehrer aus dem Jahr 2019 wies dabei einen Fettflossenschnitt auf. Recherchen haben nun ergeben, dass Fettflossenschnitte seit Jahren nicht mehr im Mittel- und Oberrheingebiet durchgeführt werden. Fettflossenschnitte werden jedoch bei den besetzten Lachsen in der Maas in Belgien durchgeführt. Auch dort werden Lachse mit der Herkunft Allier/Loire besetzt. Der Lachs wurde also sehr wahrscheinlich in der belgischen Maas ausgesetzt und ist über den Rhein in die Sieg aufgestiegen und wurde von dort in die Zucht Wildlachszentrum überführt. Die Gewebeprobe ist nun auf dem Weg nach Belgien, damit dort die möglichen Eltern ermittelt werden können.